Единица шкалы атомных весов
Единица шкалы атомных весов
Запомните, что теперь

При составлении самой первой таблицы периодического закона Д. И. Менделеев принимал атомный вес водорода равным единице и сравнивал с ним атомные веса всех других элементов.
На Международном съезде химиков в 1860 в. было решено принять водород за основу шкалы атомных весов. Почти полстолетия самый легкий элемент водород занимал это почетное место. Только в 1906 г. химики перешли к кислородной шкале, за основу шкалы атомных весов принят был атомный вес кислорода — его 1/16 часть. Это, конечно, было гораздо удобнее, так как кислород образует соединения почти со всеми элементами.
Когда было открыто, что в природе существуют три различных изотопа кислорода и что содержание их в природном кислороде непостоянно, физики установили для себя «физическую» шкалу атомных весов. Они условились считать единицей для атомных весов 1/16 веса атома наиболее распространенного легкого изотопа кислорода и вес его считать равным точно шестнадцати. Это устраняло погрешность, происходящую из-за непостоянства изотопного состава кислорода разного происхождения.
Долгое время в науке было такое «двоевластие». При современной высокой точности измерений это стало приводить к очень многим недоразумениям и ошибкам. Кроме того, выяснилось, что изотоп О16 не оправдывает возлагавшихся на него надежд и не может обеспечить необходимую точность. Он оказался неудобным эталоном для атомных весов.
Совсем недавно, в период 1958— 1961 гг., ученые еще раз пересмотрели этот исключительно важный не только для химии, но и для всего естествознания вопрос: что должно быть положено в основу современной шкалы точных атомных весов? После многочисленных тщательных исследований и подробных обсуждений было установлено, что из всех элементов только два могут претендовать на почетную роль основной константы химии и физики — фтор и углерод.
У фтора только один изотоп, и атомный вес элемента фтора — постоянная величина. Была предложена «фторная» шкала, в которой


У углерода два изотопа, но зато его соединения с водородом очень удобны для непосредственного сравнения масс атомов различных изотопов почти всех элементов. Это—важное преимущество углерода. Многие ученые настаивали на углеродной шкале; в которой за основу принимали наиболее распространенный изотоп С12.
Поскольку обе эти новые шкалы для атомных весов обладали каждая своими важными и ценными преимуществами, было решено провести всемирное голосование (опрос) ученых — химиков и физиков: какую шкалу — «фторную» или «углеродную» — они предпочитают?
В этом всемирном опросе приняли участие и ученые нашей страны. Победил углерод. Было решено за основу новой единой шкалы атомных масс принять атом изотопа углерод-12 и считать
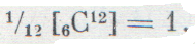
|